Bioarctics antikropp lecanemab för behandling av tidig Alzheimers sjukdom har fått Fast Track designation av FDA.
Fast Track designation för antikropp mot Alzheimers

Mest läst i kategorin
Bioarctics samarbetspartner, japanska Eisai har meddelat att den amerikanska läkemedelsmyndigheten FDA har gett svenska Bioarctics antikropp lecanemab så kallad Fast Track designation.
Läkemedelskandidaten lecanemab är riktad mot protofibriller av amyloid-beta för behandling av tidig Alzheimers sjukdom. I juni i år beviljade FDA lecanemab så kallad Breakthrough Therapy designation, som liksom Fast Track designation är avsedd att påskynda och stödja utvecklingen av nya behandlingar för allvarliga sjukdomar.
Antikroppen lecanemab
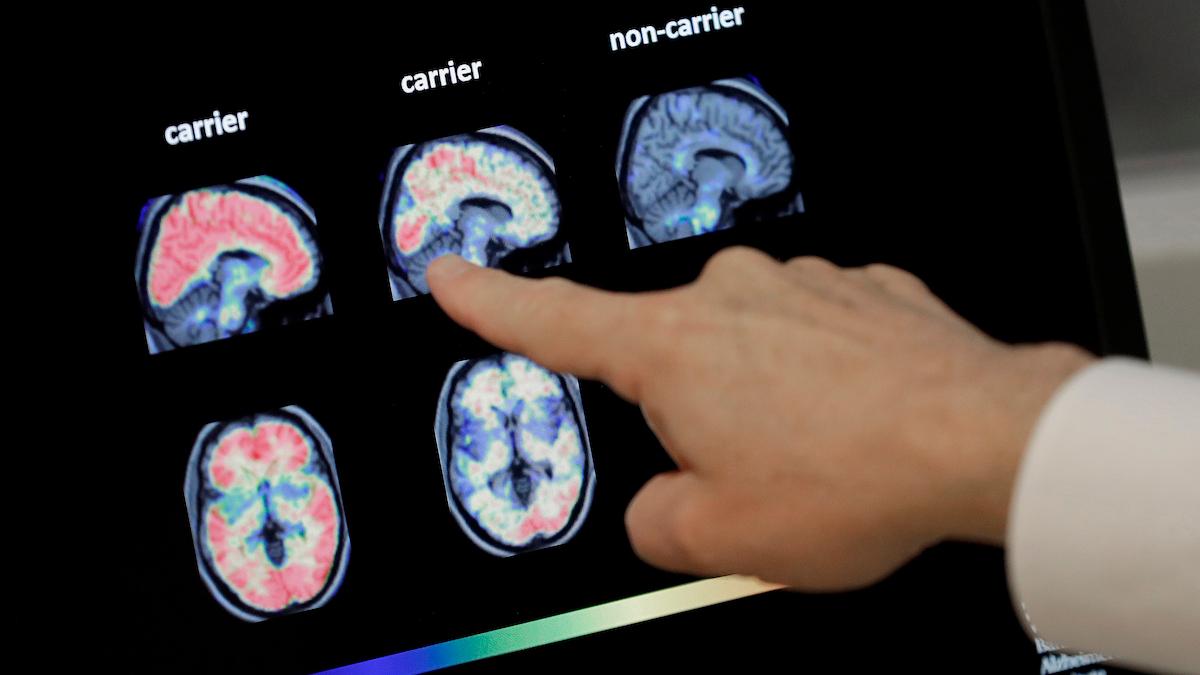
Den humaniserade monoklonala antikroppen lecanemab är resultatet av ett strategiskt forskningssamarbete mellan Bioarctic och Eisai. Antikroppen binder selektivt till amyloid-beta, och neutraliserar och eliminerar de toxiska aggregaten av amyloid-beta i hjärnan, kallade protofibriller, som anses bidra till den neurodegenerativa processen i Alzheimers sjukdom.
Eisai påbörjade i september 2021 en stegvis inlämning av ansökan för lecanemab till FDA. Ansökan består av tre delar och prekliniska och kliniska delar av ansökan har redan skickats in. Resultaten från fas 2b-studien med läkemedelskandidaten visade på en kraftfull sänkning av amyloid-beta-plack i hjärnan samt en konsekvent minskning av klinisk försämring.
Fas 3-studie pågår
Sambandet mellan omfattningen av minskningen av amyloid-beta-plack i hjärnan och effekten på kliniska efektmått ger stöd för att reduktion av amyloid-beta-plack sannolikt kan ge klinisk nytta. Nu pågår fas 3-studien av lecanemab i patienter med tidig Alzheimers sjukdom.
FDA har accepterat att fas 3-studien kan vara den bekräftande studie som verifierar den kliniska nyttan med läkemedelskandidaten och bindande säkerhetsdata från studien ingår i den stegvisa ansökan för accelererat marknadsgodkännande.
Ytterligare en klinisk fas 3-studie utvärderar effekten av behandling med lecanemab för individer med preklinisk asymptomatisk Alzheimers sjukdom, alltså personer som är kognitivt normala och har medelhöga eller förhöjda nivåer av amyloid-beta i hjärnan. Eisai har dessutom inlett en fas 1-studie för subkutan dosering av lecanemab.
Läs mer: Stegvis ansökan för läkemedel mot Alzheimers påbörjad

Reporter på Dagens PS med fokus på bland annat Life Science, hälsa och hållbarhet.

Reporter på Dagens PS med fokus på bland annat Life Science, hälsa och hållbarhet.
Senaste nytt

CONVENDUM BIG OFFICE – ökar trivseln på arbetsplatsen
CONVENDUMs olika Big Office-lösningar lockar några av landets främsta bolag. Fördelarna är många, bland annat kan trivseln bland medarbetare öka. Söker du efter en flexibel och kostnadseffektiv kontorslösning? Kontakta oss idag! Stora kontor för stora företag | CONVENDUM

Tänk inte mer på bokföringen (än du behöver)
Byt till Fortnox för en bokföring uppdaterad i realtid, som gör företagslivet smartare.